鈦及鈦合金材料在核工業(yè)、化工石化�����、航空航天���、體育用品、牙科和醫(yī)療修復(fù)等領(lǐng)域得到廣泛的應(yīng)用[1-2]����。鈦合金材料也被認(rèn)為是替代或修復(fù)失效硬組織(結(jié)構(gòu)生物醫(yī)學(xué)應(yīng)用)的最佳選擇材料[3]。由于表面形成氧化層而產(chǎn)生優(yōu)異的耐腐蝕性以及較低的彈性模量����, 鈦合金比任何其他醫(yī)學(xué)應(yīng)用材料����, 如不銹鋼、工業(yè)純(CP)Nb��、Cr-Co 合金及CP-Ta 等更能滿足性能要求[4]。醫(yī)用鈦合金的發(fā)展歷程如圖1 所示��。
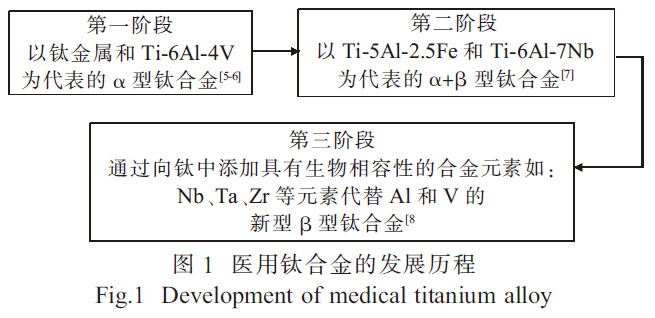
純鈦金屬抗腐蝕性能較好��, 但其生物相容性與綜合力學(xué)性能較差�����, 強(qiáng)度相對較低且生產(chǎn)成本較為昂貴�,因此鈦合金成為良好的替代品[8]�。Ti-6Al-4V合金一直是醫(yī)用鈦合金的主要成分,然而��,對于永久性植入應(yīng)用���, 該合金因釋放釩和鋁而產(chǎn)生的毒性效應(yīng)限制了其在醫(yī)學(xué)上的應(yīng)用[9]。因此�����,新型醫(yī)用鈦合金在Ti-6Al-4V 合金的基礎(chǔ)上, 引入了無釩和無鋁合金作為醫(yī)療應(yīng)用�。為降低生產(chǎn)成本和提高使用性能,醫(yī)用鈦合金的制備工藝也成為了研究的重點(diǎn)�����。
1 ��、粉末冶金
粉末冶金(PM)法[10-11]具有接近最終金屬成形的性能�����, 一直被推薦作為生產(chǎn)低成本鈦合金零件的有效方法[12],其方法流程[13]如下����,①首先制備合金粉末���;②將粉末元素進(jìn)行混合;③室溫將混合粉末進(jìn)行模壓���; ④在可控氣氛爐中燒結(jié)以在粉末元素之間建立結(jié)合��;⑤進(jìn)行后期處理。合金與降低制造成本的最大化來自于所選的起始原料���、合金元素和用于生產(chǎn)合金的加工步驟的組合。
整體形成β 相結(jié)構(gòu)是有效降低鈦合金彈性模量的途徑��,因此�,可加入無毒β 穩(wěn)定元素�。Li等[14]以球形鈦粉、非球形鈮粉、非球形鋯粉和近球形錫粉為原料����,采用粉末冶金法將幾種粉末經(jīng)過混合���、冷壓以及燒結(jié)�,成功制備了Ti-24Nb-4Zr-8Sn(wt%)合金����,其極限拉伸強(qiáng)度為760MPa,彈性模量為56.9GPa�,斷裂應(yīng)變?yōu)?5.3%���, 提高了該合金在生物醫(yī)學(xué)中所需的力學(xué)性能��。在骨科臨床醫(yī)學(xué)應(yīng)用中,提高植入物的生物相容性以及與人體骨骼的融合能力是必要的���。Xu等[15]首先利用連續(xù)惰性氣體霧化法制備Ti35.4Zr28Nb 粉體,采用粉末冶金法制備了新型多孔Ti35Zr28Nb 支架材料���,具有(132.5±3.5)MPa 的壓縮屈服強(qiáng)度以及(2.9±0.4)GPa 的彈性模量等優(yōu)異的力學(xué)性能,可作為理想的骨植入材料����。在制粉過程中對霧化技術(shù)的改進(jìn),提高粉末壓縮性和均勻性還有待提高���。

在鈦環(huán)���、鈦絲等鈦合金研發(fā)中含有更多的普通低成本�����、低熔點(diǎn)元素越來越受到重視���, 降低了昂貴稀有金屬的含量從而降低了生產(chǎn)成本。Ehtemamhaghighi等[16]采用Ti 粉�����、Mn粉、Nb 粉為原料,將粉末充分混合2 h����,在壓力550MPa 下對混合粉末進(jìn)行模壓,在高溫管式爐中將壓坯升溫至1170℃保溫8h 后冷卻�, 采用粉末冶金方法�, 從混合元素粉末中制備一系列新型Ti-Mn-Nb合金���, 通過硬度和壓縮試驗(yàn)獲得的力學(xué)性能表明����,Ti-7Mn-xNb 合金具有比純鈦金屬材料具有更高的硬度以及更低的彈性模量����。
采用粉末冶金工藝可制備出性能良好的醫(yī)用鈦合金����,也可制備出凈成形的合金�����,大大減少了后期的處理工作�,但對制粉要求較高,且燒結(jié)溫度基本都在高溫(>1000℃)下進(jìn)行����,從而增加了反應(yīng)的能耗��。
2����、 機(jī)械合金化
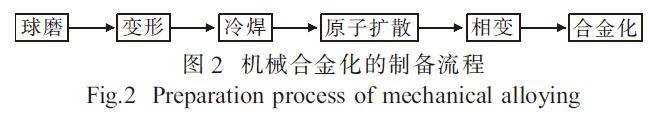
機(jī)械合金化(MA)[17-18]廣泛用于均勻化和混合元素粉末�����, 以進(jìn)一步在固態(tài)下利用元素粉末制備合金�。其制備流程[19]如圖2 所示�,可通過快速焊接和斷裂在原子水平上將元素粉末混合在一起�。在制備磁性��、超導(dǎo)等材料中取得了很大進(jìn)展[20]�����。隨著研究工作的深入, 機(jī)械合金化技術(shù)將在新材料制備中發(fā)揮更大的作用�����。
鈦合金本身一般不具有抗菌性能���, 并且由于植入物引起相關(guān)的感染而導(dǎo)致術(shù)后并發(fā)癥或植入失敗等難題����,研究者將無機(jī)抗菌劑引入鈦合金中,制備了抗菌生物醫(yī)用合金材料[21]���。Li等[22]采用工業(yè)純Ti 粉和Bi 粉經(jīng)機(jī)械合金化和后續(xù)的放電等離子燒結(jié)技術(shù)制備了二元Ti-Bi 合金,Ti-Bi 合金的壓縮屈服強(qiáng)度比工業(yè)純Ti (CP-Ti) 合金的高約22%~44%���,當(dāng)
Bi 含量為0.5%時(shí),Ti-Bi 合金具有約1080MPa 的屈服強(qiáng)度以及約2226MPa 的極限抗壓強(qiáng)度����,斷裂應(yīng)變約34.3%��, 在生物醫(yī)學(xué)中表現(xiàn)出優(yōu)異的塑性及綜合力學(xué)性能����。在鈦合金的合金元素中���,Mo 是一種很強(qiáng)的β 相穩(wěn)定劑��,能提高鈦合金的耐蝕性�����,從生物學(xué)的角度來看���,Mo 是許多對細(xì)胞代謝重要的酶的必需微量元素[23]。Ag 具有更好的抗菌作用��,同時(shí)保持了與純Ti 相似的生物相容性�����。Zhang等[24]利用具有β 相的穩(wěn)定元素Mo 和抗菌元素Ag���, 以原子比為18∶1∶1 的純Ti、Mo 和Ag 為起始原料�����, 采用機(jī)械合金化和放電等離子燒結(jié)相結(jié)合的方法制備了大塊細(xì)粒Ti-5Mo-5Ag 合金��,900℃燒結(jié)的合金呈現(xiàn)出89%的β 相基體���,平均晶粒尺寸為(8.1±3.2)μm��,11%的α 相在晶界/ 三界處有微米/ 亞微米級析出相的網(wǎng)狀組織��,其屈服強(qiáng)度高達(dá)(1694±8.4)MPa���,斷裂應(yīng)變?yōu)?3%。與純Ti 相比�,所制備的Ti-5Mo-5Ag 合金還表現(xiàn)出較強(qiáng)的耐蝕性和優(yōu)異的抗菌活性��。
機(jī)械合金化優(yōu)點(diǎn)是時(shí)間短�����、能耗低����、涂層附著力好、形成各種結(jié)構(gòu)涂層的柔韌性好�����,可很容易地獲得所需的化學(xué)成分和結(jié)構(gòu)的涂層����。
3、增材制造技術(shù)
增材制造(AM)技術(shù)[25-26]��,也稱為3D 打印技術(shù)��,以3D 模型將材料連接起來逐層進(jìn)行數(shù)據(jù)制備合金的工藝����,與減材制備合金技術(shù)相反�����。它涵蓋了一系列使用逐層方法來構(gòu)建零件或產(chǎn)品的技術(shù)�����, 主要有電子束熔煉技術(shù)和選擇性激光熔化[27]�����,以粉末為原料的AM 技術(shù)是制造金屬合金材料最常用的方法�����。
3.1 電子束熔煉技術(shù)
電子束熔煉(EBM)技術(shù)[28-29]是以電子束為熱源��,在高溫、高真空條件下使用前體金屬粉末精確分層制備復(fù)雜金屬合金結(jié)構(gòu)��。根據(jù)3D 模型�����,來自焊槍的電子束由偏轉(zhuǎn)線圈控制并聚焦在金屬粉末床上��,粉末通過熔化與電子束反應(yīng)��, 然后由兩個粉末盒添加另一粉末層�, 新粉末通過粉耙均勻地分布在整個表面上���,并且該過程以逐層方式繼續(xù)進(jìn)行,直到零件達(dá)到最終成形[30]���。此外�,EBM 技術(shù)還可加工高熔點(diǎn)或高硬度的金屬�����, 這些顯著的優(yōu)點(diǎn)使得EBM 不僅在工業(yè)上���,而且在醫(yī)學(xué)領(lǐng)域都具有極大的吸引力�,能使植入物準(zhǔn)確地適應(yīng)不同的缺陷位置��。
采用多孔結(jié)構(gòu)可以降低鈦合金零件與人體骨骼之間的模量差�����。Chen等[31]以預(yù)合金Ti-6Al-4V 粉末為原料����, 采用電子束熔化技術(shù)制備了具有金剛石晶格韌帶結(jié)構(gòu)��、孔隙率高達(dá)80%的多孔Ti-6Al-4V 泡沫材料����,對于所有80%孔隙率的不同韌帶寬度和孔徑的EBM 泡沫材料�, 可以很好匹配人體松質(zhì)骨的楊氏模量和應(yīng)力水平, 有效降低應(yīng)力遮擋效應(yīng)的風(fēng)
險(xiǎn)��。Almanza等[32]以Ti-6Al-4V 合金粉末采用電子束熔煉技術(shù)制備了Ti-6Al-4V 合金��,降低了0.50~0.14mm/a 的腐蝕速率���,可提高長期植入物的抗腐蝕性。

電子束熔煉技術(shù)可用于制備難以加工��、需要昂貴工具的合金。真空條件為電子束熔煉提供了一個可控的環(huán)境���,以傳統(tǒng)的方式減少了制備合金的缺陷,從而提高了合金的耐腐蝕性等���。
3.2 選擇性激光熔化
選擇性激光熔化(SLM)[33-34]技術(shù)是一種分層的成形工藝, 能實(shí)現(xiàn)高幾何復(fù)雜度的合金零件接近凈形狀生產(chǎn)��,它是對傳統(tǒng)鈦合金零件生產(chǎn)路線(如鍛造和鑄造)的補(bǔ)充��。在SLM 中�����,在粉末床上鋪上一薄層金屬合金粉末�����,并用高功率激光選擇性地熔化�,這個過程逐層重復(fù),直到制備出整個合金零件[35]���。由于SLM 獨(dú)特的成形工藝���,不同的成形方向得到不同的織構(gòu)成分, 從而使醫(yī)療器械或植入物具有不同各向異性的性能��。
在生物醫(yī)學(xué)中���, 選擇性激光熔化制備的最終植入物是通過積累層獲得,除了致密的植入物外�,SLM還可制造具有格狀結(jié)構(gòu)的定制植入物�����, 從而使新骨組織向內(nèi)生長并輸送體液�。Luo等[36]首先通過等離子旋轉(zhuǎn)電極法制備Ti-30Nb-5Ta-3Zr(TNTZ)合金粉末,再采用選擇性激光熔化制備了Ti-30Nb-5Ta-3Zr合金�����,TNTZ 的拉伸強(qiáng)度、楊氏模量����、伸長率和疲勞極限分別為~680 MPa����,~64.2 GPa���,~15.3%和~140MPa�����。當(dāng)孔隙率為77.23%(體積) 的晶格結(jié)構(gòu)時(shí)��,TNTZ 樣品屈服強(qiáng)度范圍為15.7~520MPa�����,可用于修復(fù)或代替人類皮質(zhì)骨����, 沒有細(xì)胞毒性, 并且比Ti-6Al-4V 表現(xiàn)出更好的生物相容性��,低應(yīng)力屏蔽趨勢和較高的力學(xué)性能��。增材制造技術(shù)可用于制備生物醫(yī)學(xué)應(yīng)用的開孔金屬支架, 與傳統(tǒng)的制造工藝相比�,具有許多優(yōu)勢。Li等[37]首先使用可消耗電極真空電弧爐熔融法制備出Ti35Zr28Nb 合金錠�����,再利用等離子體旋轉(zhuǎn)電極霧化系統(tǒng)將合金錠霧化成球形粉末����, 最后采用選擇性激光熔化制備用于生物醫(yī)學(xué)應(yīng)用的塊狀和多孔狀新型β-Ti35Zr28Nb 合金支架�。得出:①SLM 制備的大塊樣品在縱向和橫向分別顯示出57�����、60GPa 的彈性模量�����, 以及612���、768MPa 的壓縮屈服強(qiáng)度�;②SLM 制備的孔隙率為83%的支架在縱向和橫向上的彈性模量值分別為1.1���、0.7GPa���,抗壓屈服強(qiáng)度值分別為27��、8MPa���;③SLM 制造的孔隙
率為50%的支架在縱向和橫向上的彈性模量值為1.3、1.0 GPa��, 抗壓屈服強(qiáng)度值分別為58�、45MPa���,SLM 制備的Ti35Zr28Nb 支架具有良好的腐蝕性能和生物相容性。

選擇性激光熔化技術(shù)能夠使用合金粉末直接制備復(fù)雜的網(wǎng)狀植入物��, 具有可用于生物醫(yī)學(xué)應(yīng)用中定制植入物結(jié)構(gòu)的特點(diǎn)�,然而,也存在著成本高�、效率低等缺點(diǎn)。
4�、 結(jié)語與展望
(1) 鈦絲���、鈦棒等鈦合金與純金屬材料相比,具有獨(dú)特的生物醫(yī)學(xué)應(yīng)用優(yōu)勢�����, 已被用作制造骨科假體和牙種植體的結(jié)構(gòu)生物材料中�,可改善患者的健康狀況���,使患者能無痛苦正常生活����,延長人類壽命�����。
(2) 粉末冶金法是制備生物醫(yī)療器械的傳統(tǒng)方法, 使用預(yù)合金或混合元素等不同類型的粉末可擴(kuò)大不同應(yīng)用����,達(dá)到所需要的性能范圍����;可降低制備成本�,將部件制備達(dá)到接近凈形狀,但模壓過程中需要的模具成本較高。
(3) 機(jī)械合金化能有效降低合金化溫度���,簡化難熔元素合金的制備����,通過調(diào)節(jié)工藝參數(shù)�,可以很容易地獲得均勻、精細(xì)�、甚至納米晶的微觀結(jié)構(gòu)�����。因此����,通過機(jī)械合金化可以制備出化學(xué)成分分布均勻、納米晶體結(jié)構(gòu)的材料�����, 氣體環(huán)境也可能會影響合金的性能���, 對于制備特殊的合金更需要成本較高的特殊氣體作為保護(hù)氣��。
(4) 電子束熔煉法能在不使用傳統(tǒng)工具���、低制造成本、更快的時(shí)間和最少的人為干預(yù)的情況下�����,更精確地獲得尺寸可控��、幾何形狀更復(fù)雜的產(chǎn)品��,可以獲得較短的制備周期�����,省略大量的機(jī)械加工�,可以降低材料的制備成本和制備產(chǎn)生的廢料, 從而降低對環(huán)境的影響����,但在制備過程中對真空度要求較高���。選擇性激光熔化能經(jīng)濟(jì)高效地制備復(fù)雜形狀的致密合金,制備步驟少����,靈活性好并且材料利用率較高,可直接獲得與鍛造合金一樣的優(yōu)異力學(xué)性能�。在真空條件下,氣體的體積將大大減小�,提高合金材料的質(zhì)量����, 但金屬材料的加熱和冷卻速率也可能會強(qiáng)烈影響最終材料的力學(xué)性能與生物相容性���。
(5) 提高生物醫(yī)用鈦合金材料與人體的相容性�����、降低合金材料在使用過程中產(chǎn)生的應(yīng)力屏蔽效應(yīng)以及醫(yī)用鈦合金的彈性模量等性能是未來的研究方向�, 使新型醫(yī)用鈦合金材料在人體中不產(chǎn)生副反應(yīng)��。采用二種或多種方法結(jié)合降低制備成本提高制備效率�, 研究出最適合綠色工業(yè)化生產(chǎn)生物醫(yī)用鈦合金的工藝�����。
參考文獻(xiàn):
[1] Oh J M�, Park C H�, Yeom J T�����, et al.High strength andductility in low-cost Ti-Al-Fe-Mn alloy exhibitingtransformation-induced plasticity [J]. Materials Science andEngineering A�����,2020�,772:138813-138822.
[2] 周泉�, 丁澤良, 王易�, 等.Ti6Al4V 鈦合金表面Ta2O5/Ta2O5-Ti/Ti 多涂層的制備與性能研究[J]. 包裝學(xué)報(bào),2019��,11(6):23-30.
[3] Yan L�����, Yu J, Zhong Y���,e t al. Influence of scanning on nanocrystalline β-Ti alloys fabricated by selective laser melting andtheir applications in biomedical science [J].Journal ofNanoscience and Nanotechnology��,2020����,20(3):1605-1612.
[4] Jackson M J���, Kopac J���, Balazic M, et al. Titanium andtitanium alloy applications in medicine[M].Surgical Tools andMedical Devices:Springer���,Cham,2016:475-517.
[5] 張遠(yuǎn). 醫(yī)用純鈦及Ti-6Al-4V 表面微納結(jié)構(gòu)的制備及生物相容性研究[D].長沙:湖南大學(xué)�,2018.
[6] Li X P, Ji G��, Eder K���, et al. Additive manufacturing of anovel alpha titanium alloy from commercially pure titaniumwith minor addition of Mo2C[J].Materialia,2018����,4:227-236.
[7] Jia M T����, Gabbitas B���, Bolzoni L.Evaluation of reactiveinduction sintering as a manufacturing route for blendedelemental Ti-5Al-2.5Fe alloy [J].Journal of MaterialsProcessing Technology�,2018��,255: 611-620.
[8] Weng W J��, Arne B�, Li Y C���, et al. Effects of selectedmetallic and interstitial elements on the microstructure andmechanical properties of beta titanium alloys for orthopedicapplications[J]. Materialia,2019��,6:100323-100332.
[9] Elias C N�����, Lima J H C�����, Valiev R�����, et al.Biomedicalapplications of titanium and its alloys [J]. Jom����,2008����,60(3):46-49.
[10] Guo W M, Liu B�, Liu Y, et al. Microstructures and mechanical properties of ductile NbTaTiV refractory high entropy alloyprepared by powder metallurgy [J].Journal of Alloys andCompounds����,2019�,776: 428-436.
[11] 魏文慶,曹光明����,劉炳強(qiáng)���,等.粉末冶金Nb-35Ti-6Al-5Cr-8V合金組織演變及其力學(xué)行為[J]. 稀有金屬材料與工程��,2019,48(12):4106-4112.
[12] Niu H Z�����, Zhang H R��, Sun Q�, et al. Breaking through thestrength-ductility trade-off dilemma in powder metallurgyTi-6Al-4V titanium alloy[J].Materials Science and EngineeringA,2019���,754:361-369.
[13] Nassar A, Nassar E.Properties of aluminum matrix Nanocomposites prepared by powder metallurgy processing [J].Journal of King Saud University: Engineering Sciences��,2017�,29(3):295-299.
[14] Li X����, Ye S L, Yuan X N�����, et al. Fabrication of biomedicalTi-24Nb-4Zr-8Sn alloy with high strength and low elasticmodulus by powder metallurgy [J]. Journal of Alloys andCompounds�,2019���,772: 968-977.
[15] Xu W����, Tian J J�, Liu Z, et al. Novel porous Ti35Zr28Nbscaffolds fabricated by powder metallurgy with excellentosteointegration ability for bone-tissue engineering applications[J].Materials Science and Engineering C����,2019,105:110015-110024.
[16] Ehtemamhaghighi S��, Attar H���, Dargusch M S��, et al.Microstructure�,phase composition and mechanical properties ofnew,low cost Ti-Mn-Nb alloys for biomedical applications [J].Journal of Alloys and Compounds��,2019�����,787:570-577.
[17] Jiang J��, Shen Y F���, Feng X M.Microstructure evolution,formation mechanisms and properties of SiCp/Al compositecoatings on Ti-6Al-4V substrate via mechanical alloying method[J]. Surfaces and Interface�����,2020��,19:100487-100496.
[18] 顏建輝����,李凱玲���,汪異,等.機(jī)械合金化和放電等離子燒結(jié)制備NbMoCrTiAl 高熵合金[J]. 材料導(dǎo)報(bào)����,2019,33 (10):1671-1675.
[19] Suryanarayana C. Mechanical alloying and milling [J].Progress in Materials Science,2001��,46(1/2):1-184.
[20] Tian Y����, Shen Y�, Lu C����, et al. Microstructures and oxidationbehavior of Al-CrMnFeCoMoW composite coatings onTi-6Al-4V alloy substrate via high-energy mechanical alloyingmethod [J]. Journal of Alloys and Compounds,2019����,779:456-465.
[21] Lei Z M, Zhang H Z�, Zhang E L, et al. Antibacterialactivities and biocompatibilities of Ti-Ag alloys prepared byspark plasma sintering and acid etching [J]. Materials Scienceand Engineering C�����,2018,92:121-131.
[22] Li Z J��, Dong A P, Xing H�, et al. Microstructure andmechanical properties of bimodal TiBi alloys fabricated bymechanical alloying and spark plasma sintering for biomedicalapplications [J].Materials Characterization,2020�����,161:110134-110145.
[23] Chen Q Z, Thouas G A.Metallic implant biomaterials [J].Materials Science and Engineering: R: Reports����,2015,87(87):1-57.
[24] Zhang Y W���, Chu K J, He S����, et al.Fabrication of highstrength,antibacterial and biocompatible Ti-5Mo-5Ag alloy formedical and surgical implant applications[J].Materials Scienceand Engineering C�����,2020�,106:110165-110173.
[25] 王祥,張林杰�����,李森����,等.增材制造Ti-6Al-4V 組織的演化與拉伸性能的差異[J].航空制造技術(shù),2019���,62(17):88-94.
[26] Neikter M, 魡kerfeldt P��, Pederson R�����, et al. Microstructuralcharacterization and comparison of Ti-6Al-4V manufacturedwith different additive manufacturing processes [J].MaterialsCharacterization���,2018,143:68-75.
[27] Fojt J��, Fousova M���, Jablonska E��, et al.Corrosion behaviourand cell interaction of Ti-6Al-4V alloy prepared by two techniquesof 3D printing [J].Materials Science and EngineeringC,2018����,93:911-920.
[28] Hara D, Nakashima Y�����, Sato T����, et al.Bone bonding strengthof diamond-structured porous titanium-alloy implants manufacturedusing the electron beam-melting technique [J]. MaterialsScience and Engineering C���,2016�,59:1047-1052.
[29] 李建兵��,馬治龍�����,王強(qiáng)��,等.電子束法生產(chǎn)金屬釩用釩鋁合金制備工藝的研究[J].湖南有色金屬����,2019���,35(4):39-42.
[30] Fiaz H S��, Settle C R����, Hoshino K.Metal additivemanufacturing for microelectromechanical systems:titaniumalloy (Ti-6Al-4V)-based nanopositioning flexure fabricated byelectron beam melting [J].Sensors and Actuators A: Physical���,2016,249:284-293.
[31] Chen S Y�����, Kuo C N�����, Su Y L�����, et al. Microstructure andfracture properties of open-cell porous Ti-6Al-4V with highporosity fabricated by electron beam melting [J]. MaterialsCharacterization���,2018,138:255-262.
[32] Almanza E���, Pérez M J���, Rodríguez N A, et al.Corrosionresistance of Ti-6Al-4V and ASTM F75 alloys processed byelectron beam melting [J].Journal of Materials Research andTechnology�,2017�����,6(3):251-257.
[33] Jiang X J��, Chen G Y����, Men X L�����, et al. Grain refinement andexcellent mechanical properties of a Ti-based alloy via lasermelting and subsequent low temperature annealing[J]. MaterialsScience and Engineering A��,2018�����,737:182-187.
[34] 彭丹華���,張正文��,張凱飛����,等.選擇性激光熔化成形Ti6Al4V鈦合金的滾動接觸疲勞性能研究[J].機(jī)械強(qiáng)度����,2019���,41(1):60-65.
[35] Moridi A���, Demir A G, Caprio L�, et al. Deformation andfailure mechanisms of Ti-6Al-4V as built by selective lasermelting [J]. Materials Science and Engineering A,2019�����,768:138456-138465.
[36] Luo J P���, Sun J X�, Huang Y F��, et al. Low-modulusbiomedical Ti-30Nb-5Ta-3Zr additively manufactured bySelective Laser Melting and its biocompatibility [J].MaterialsScience and Engineering C�����,2019,97: 275-284.
[37] Li Y C��, Ding Y F��, Munir K S����, et al. Novel β-Ti35Zr28Nballoy scaffolds manufactured using selective laser melting forbone implant applications [J].Acta biomaterialia,2019�����,87:273-284.
相關(guān)鏈接












